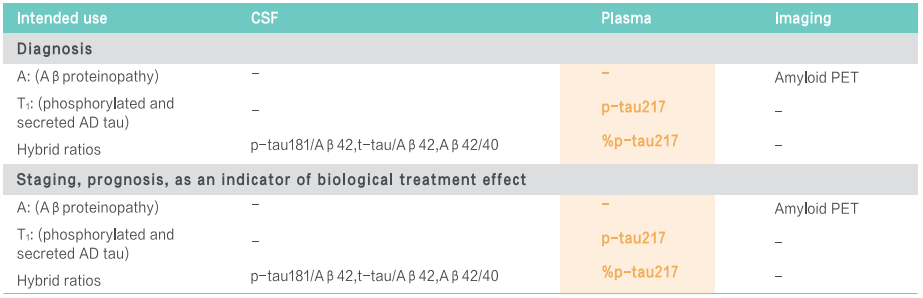
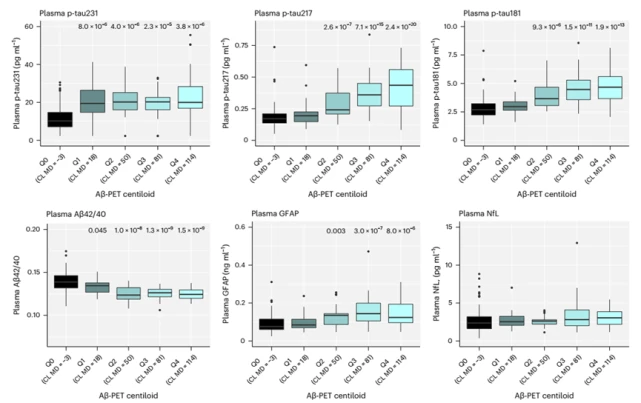
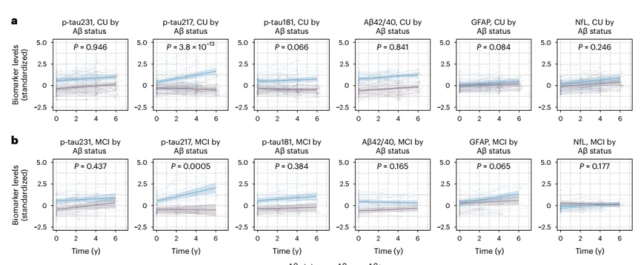
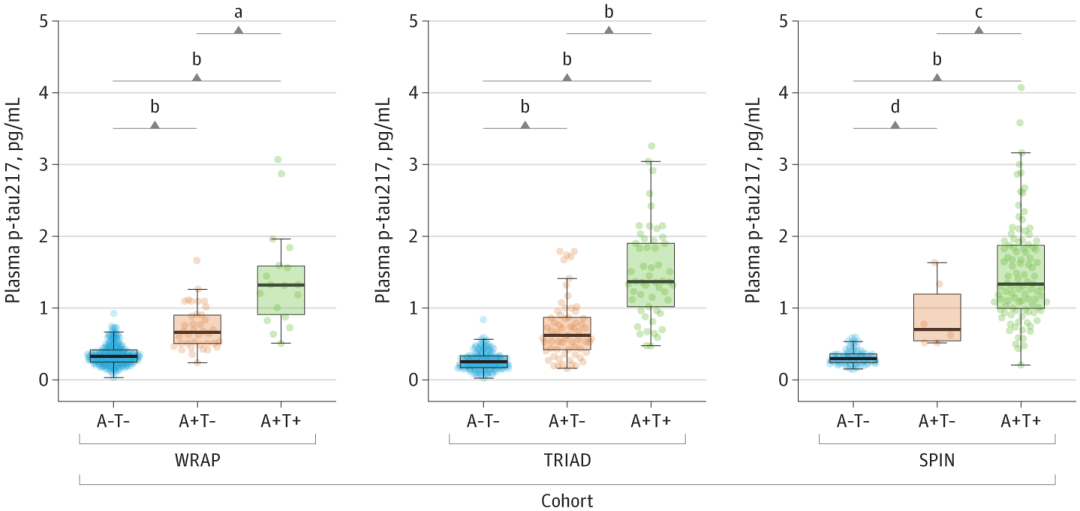
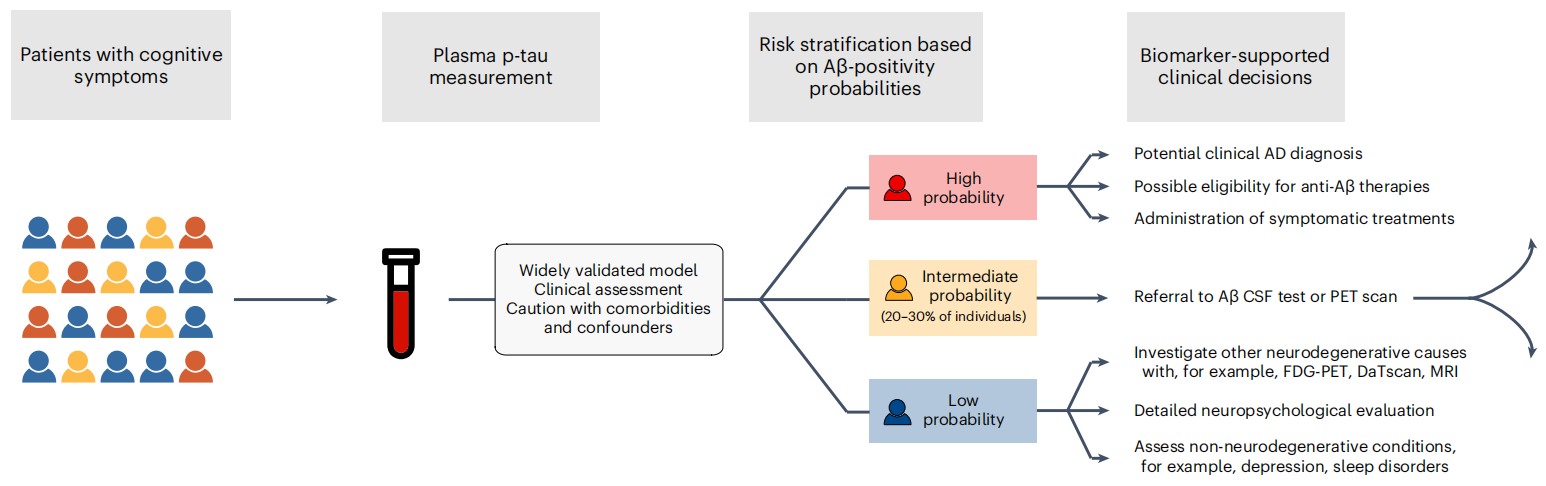
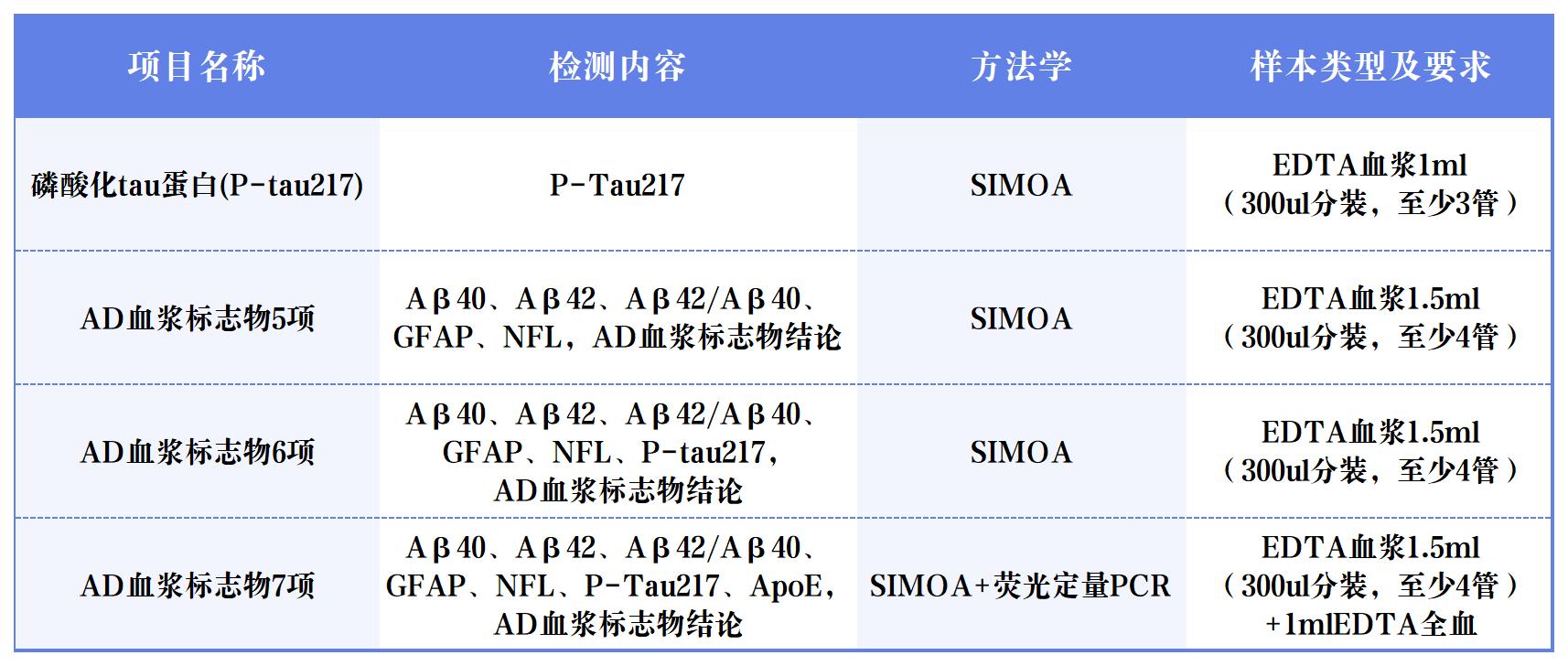
面對這一全球性難題,早篩早診成為突破瓶頸的關鍵[1]。近年來,血液標志物憑借其微創、便捷和適合大規模應用的優勢,在AD早期篩查、診斷、分期、進展預測等方面嶄露頭角[2]。在眾多Aβ和Tau蛋白相關標志物中,磷酸化Tau蛋白217(Phosphorylated Tau 217,簡稱P-Tau217)展現出獨特潛力。 國際指南認證:準確的P-Tau217檢測能夠用于AD診斷 美國衰老研究所與阿爾茨海默病協會(NIA-AA)于2024年7月發布了《Revised Criteria for Diagnosis and Staging of Alzheimer's Disease: Alzheimer’s Association Workgroup》[3],指出“血漿生物標志物P-Tau217能夠用于AD診斷、分期、預后與治療效果評估”,其他血漿生物標志物僅能夠用于AD的分期、預后與治療效果評估,而非用于診斷。 圖1 《阿爾茨海默病診斷與分期標準》NIA-AA(2024年修訂版) 血漿P-Tau217的沉積與AD病程發展相關性高 隆德大學的Oskar Hansson團隊和哥德堡大學的Kaj Blennow團隊發布的一項研究[4]顯示,在區分認知無障礙的參與者(CU,n=388)和輕度認知障礙患者(MCI,n=187)的一眾標志物里,P-Tau217和P-Tau181在Aβ負擔較高的參與者中,顯示出水平的持續增加。其中,P-Tau217變化趨勢明顯更大。 圖2 各個血液標志物在不同Aβ-PET Centiloid量表得分患者中的水平變化[4] 隨后對部分參與者長達6年的隨訪結果顯示,無論是CU參與者還是MCI患者,相比于Aβ-參與者,僅有P-Tau217在Aβ+參與者中有縱向增加(P< 0.001)。而且,只有P-tau217的縱向變化與患者認知功能的下降和腦萎縮程度,具有明顯相關性。 圖3 CU參與者和MCI患者血液標志物的縱向變化[4] 血漿P-Tau217檢測可準確識別AD的病理變化,與腦脊液生物標志物檢測相當 一項于《JAMA Neurology》發表的3個單中心原創性觀察隊列[5]納入了786名受試者(包括504名女性和282名男性)。P-Tau217在各個隊列中檢測識別Aβ(AUC:0.92~0.96;95% CI:0.89~0.99)和Tau(AUC:0.93~0.97;95% CI:0.84~0.99)異常的準確性較高,與腦脊液生物標志物識別異常PET信號的準確性相當。此外,使用三分法劃定參考范圍判定Aβ病理的異常,其結果可重復性高,同時減少了約80%的腦脊液驗證。 長達8年的縱向跟蹤觀察發現,僅在Aβ陽性個體中觀察到血漿P-Tau217水平的逐年上升,而Tau陽性個體中血漿P-Tau217水平的上升幅度最大。 圖4 不同Aβ(A)和Tau(T)狀態下的血漿P-Tau 217水平[5] 血漿P-Tau217應用于臨床,可減少MCI患者不必要的CSF和PET檢測 哥德堡大學的Wagner S.Brum和隆德大學的Oskar Hansson等人[6],針對P-Tau217血液水平和已知的兩項Aβ陽性預測因子(年齡、APOE e4基因表達情況)構建的數學模型,成功實現對MCI患者的Aβ陽性風險的預測。 根據結果對MCI患者進行分層,分為低、中、高風險組。其中,中風險組患者的Aβ狀態需要接受第二步來確認,即基于CSF中的Aβ42/Aβ40比值進行評估;高風險組接受進一步的AD臨床診斷或抗Aβ抗體治療;低風險組則繼續排查其它類型的神經退行性疾病或接受心理學評估。 研究結果證實,這種基于P-Tau217血液水平的檢測方法,準確度可高達92.0%,并幫助61.2%-85.9%的MCI患者避免不必要的CSF檢測。 圖5 基于p-tau217的血液檢測來篩查AD高危人群的實踐流程[6] 迪安診斷阿爾茨海默病檢測整體化解決方案 迪安診斷基于單分子免疫SIMOA平臺開展的P-Tau217檢測,能夠精準捕捉早期疾病信號,用于對AD高危群體的早期篩查和AD的輔助診斷。 一旦識別出AD源性MCI或者AD患者,臨床便能立即啟動醫療與生活方式的綜合性干預,為患者爭取到更多的時間和機會,以維持較高的生活質量,并減輕家庭和社會的負擔。 作為醫學診斷整體化解決方案提供者,迪安診斷神經&免疫疾病中心依托涵蓋IP-MS(免疫沉淀-質譜)、SIMOA、ELISA、單分子蛋白超高靈敏度檢測平臺、化學發光、測序等多技術平臺,針對阿爾茨海默病的疾病特點以及診療進展,開展血漿、腦脊液、尿標記物的檢測,助力臨床開展AD早篩、診斷、分級、治療監測等,造福終端患者。 參考文獻 1. 中國阿爾茨海默病藍皮書(精簡版) [J]. 中 華 醫 學 雜 志 , 2024, 104(29): 27012727. 2. 阿爾茨海默病體液標志物臨床應用中國指南(2024版) 3.Jack CR Jr, Andrews JS, Beach TG, et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 2024;20(8):5143-5169. 4. Ashton NJ, Janelidze S, Mattsson-Carlgren N, et al. Differential roles of Aβ42/40, p-tau231 and p-tau217 for Alzheimer’s trial selection and disease monitoring. Nature Medicine 2022. 5. Ashton N J, Brum W S, Di Molfetta G, et al. Diagnostic Accuracy of a Plasma Phosphorylated Tau 217 Immunoassay for Alzheimer Disease Pathology[J]. JAMA Neurol. 2024 Mar 1;81(3):255-263. 6. Brum WS, Cullen NC, Janelidze S, et al. A twostep workflow based on plasma ptau217 to screen for amyloid β positivity with further confirmatory testing only in uncertain cases[J]. Nat Aging, 2023, 3(9): 107910